白血病,是一种令人“谈虎色变”的恶性肿瘤,俗称“血癌”。由中国学者提出的三氧化二砷(ATO)已获批成为急性早幼粒细胞白血病治疗的药物。
为提升其治疗效果并扩展适应症,中国科学院过程工程研究所生化工程国家重点实验室研究员马光辉、魏炜课题组提出一种“仿生递送”新策略,并联合北京大学教授马丁和南方医科大学珠江医院教授李玉华开展了紧密合作,利用体内存在的天然铁蛋白颗粒(Fn)作为药物载体,解决了Fn高效装载ATO的难题并实现了靶向递送,显著抑制了多种白血病的进展。
研究论文于北京时间2021年10月25日晚23时在《自然—纳米技术》(Nature Nanotechnology)上发表。
仿生递送的原理是基于体内天然颗粒创建药物载体,并借助体内固有路径靶向递送药物。其优势是能够克服体内复杂环境和多重屏障,并且具有较高的成药性。
研究团队首先收集大量临床外周血和骨髓样本,发现健康样本中的红细胞、淋巴细胞、单核细胞和粒细胞的CD71表达水平较低(平均阳性率<10%),而患者样本中白血病细胞的cd71表达水平显著升高(平均阳性率>90%)。CD71的特异性高表达不受限于白血病的类型和进程,证明了其作为白血病细胞广谱靶点的可行性。
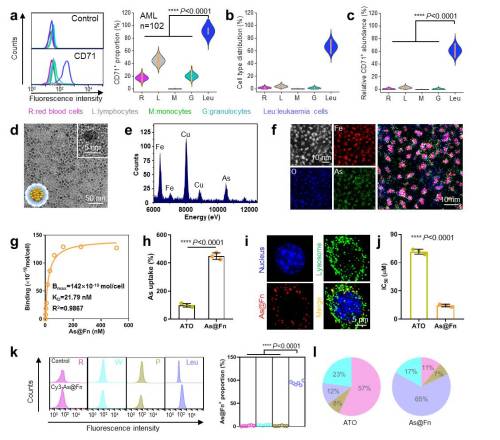
图1:白血病细胞CD71表达、As@Fn的构建和靶向性分析:(a)白血病患者骨髓中各细胞群CD71表达阳性率;(b)各细胞群比例;(c)各细胞群C71表达丰度;(d)As@Fn透射电镜图;(e)As@Fn能谱图;(f)As@Fn球差电镜图;(g)As@Fn和白血病细胞特异性结合曲线;(h)As@Fn和ATO的白血病细胞内吞比较;(i)As@Fn的胞内定位;(j)As@Fn和ATO对于白血病细胞的IC50比较;(k)As@Fn体内靶向白血病细胞分析;(l)As@Fn和ATO的体内分布比较(研究团队供图)
在此基础上,研究团队提出利用CD71配体Fn作为载体靶向递送ATO,以此提高治疗效果并降低副作用。
据介绍,研究过程中,由于Fn内腔直径小于8纳米,空间十分有限,这对小分子ATO的高效装载和可控释放提出了挑战。为解决这一难题,研究团队基于Fn的耐热性能、铁对Fn内腔的亲和性以及砷与铁的相互作用,巧妙设计铁预成核的策略并高效锚定了三价砷(Fn:As=1:200),形成砷基铁蛋白(As@Fn)。
实验显示,静脉注射后,砷基铁蛋白可以借助CD71的识别,靶向富集于白血病细胞,并在胞内酸性溶酶体中选择性释放活性三价砷,高效杀伤白血病细胞。
研究人员认为,这意味着,上述仿生靶向递送策略显著提高了临床砷制剂的耐受剂量,并且将适应症扩展至急性髓系、急性淋系和慢性髓系等多种白血病类型。
同时,研究团队在临床样本和患者来源的异种移植模型上证明,砷基铁蛋白可显著抑制多种白血病的进展,效果显著优于现有的单独ATO和联合化疗策略。
据研究人员介绍,上述成果仍属于临床前研究,实际临床疗效仍有待进一步验证。鉴于Fn为人体内源组分并且ATO为已批准用药,该制剂具有较好临床转化潜力。研究团队正在按照相关要求合作推进后续的研发和转化。
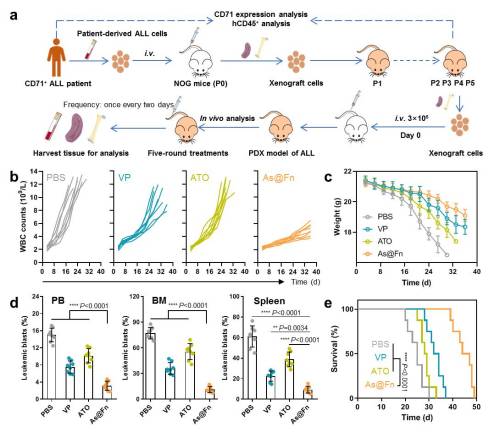
图2:As@Fn在病人来源白血病异种移植模型上的疗效:(a)白血病PDX模型构建及药效分析示意图;(b)不同治疗组小鼠白细胞变化曲线;(c)不同治疗组小鼠体重变化曲线;(d)不同治疗组小鼠外周血(PB)、骨髓(BM)和脾脏中白血病细胞的比例;(e)不同治疗组小鼠的生存曲线(研究团队供图)
据悉,十余年来,马光辉、魏炜团队发现和创制了一系列药物和疫苗递送新剂型,在动物模型上成功用于肿瘤、传染病、炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床前和临床研究。
本论文通讯作者为中科院过程工程所研究员马光辉、北京大学教授马丁北京大学、中科院过程工程所研究员魏炜和珠江医院教授李玉华;第一作者为中科院过程工程所博士研究生王昌龙、北京大学博士章伟和珠江医院副主任医师贺艳杰。











