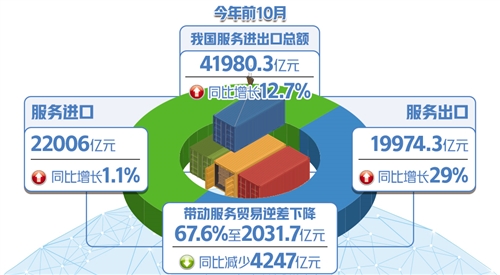
一旦停药,病毒就会卷土重来。艾滋病药物与人类免疫缺陷病毒(HIV)之间犹如警匪之战——警察出动,犯罪分子就会躲回“老窝”;一旦收兵,它们会立刻东山再起。要想一举剿灭HIV病毒,必须摸清它的“老窝”,也就是病毒潜伏库。
在12月17日发表于《细胞》的一项研究中,中国医学科学院病原生物学研究所教授何玉先团队与中国医学科学院医学实验动物研究所研究员薛婧团队合作,发现了艾滋病的强效治疗和预防药物,探寻了HIV病毒的“老窝”,初步揭示了病毒潜伏库特征和免疫控制机制。
“停”不下来的药
由于尚无有效的根治药物和疫苗,艾滋病也被称为“超级癌症”“世纪杀手”。据世界卫生组织消息,2020年全球约有3770万艾滋病毒感染者,68万人死于艾滋病病毒相关原因。中国疾控中心发布的《中国疾控中心周报》显示,截至2020年底,我国共有105.3万人感染艾滋病病毒,累计报告死亡35.1万人。
研究新的艾滋病长效治疗和预防方法不仅是当前重大的科学问题,也是研究的难点,更是患者的迫切需求。
截至目前,高效抗逆转录病毒疗法(HAART)是治疗HIV感染者和艾滋病患者的主要方法,也称“鸡尾酒”疗法。该方法可以有效抑制HIV复制,并将病毒载量降至血液中检测不到的水平。
虽然“鸡尾酒”疗法大大降低了HIV相关感染疾病的死亡率,但由于病毒潜伏库的存在,一旦停药,HIV会迅速反弹。在这场“战斗”中,HIV病毒就像狡猾的犯罪分子,能够整合到靶细胞的基因组中,并随着靶细胞潜伏到身体的各个角落里,不显山不露水。而作为警察的艾滋病药物,一旦认为局势安全,收兵回营,潜伏的HIV病毒就会被激活而继续复制,实现反弹。
这就造成艾滋病患者一旦停止服药就会复发。然而,长期服药,患者会面临病毒变异耐药和药物毒性积累等问题。因此,实现“停药后稳定的病毒控制”,即功能性治愈,是现阶段艾滋病防治领域的理想目标,而其中的关键就是探明稳定病毒控制背后的病毒潜伏库和免疫调节机制。
薛婧告诉记者,“如果我们能够知道病毒潜伏库的特征,找到病毒潜伏库,就能为下一步精准打击HIV病毒奠定基础。”
研究团队研发了一种具有极高抗HIV活性且长效的脂肽病毒膜融合抑制剂LP-98,可作为有效的HIV治疗和预防策略,并揭示了病毒潜伏库和免疫控制机制。
膜融合抑制剂,也称病毒进入抑制剂,不同于其他在病毒感染细胞后才发挥作用的艾滋病药物,它主要作用于病毒感染的早期阶段,就像“拒敌人于国门之外”。“新设计的基于脂肽的膜融合抑制剂不但具有极高的病毒抑制活性,在体内也具有长效作用,更适合艾滋病高危人群的用药习惯,提高依从性。”薛婧表示。
深入“毒巢”
研究人员在对21只感染病毒的恒河猴进行治疗后发现,低剂量单药治疗能够有效抑制猴—人免疫缺陷嵌合病毒 (SHIV)复制,且维持长期有效的治疗效果。更重要的是,在对停药后的感染猴进行长期的病毒核糖核酸(RNA)监测后,研究人员发现了3种不同的停药后状态。20%左右的治疗猴表现出最为理想的“停药后稳定的病毒控制”状态,40%左右的治疗猴呈停药后稳定的病毒反弹状态,30%左右的治疗猴呈停药后病毒不稳定反弹状态。
接下来,他们进一步探究了3组治疗猴的病毒潜伏库特征,发现病毒稳定控制猴的病毒DNA以低水平“潜伏”于深部淋巴结,而停药后病毒反弹猴的病毒DNA以较高水平“潜伏”在浅表淋巴结,这提示病毒DNA的潜伏库部位和水平与停药后是否反弹有密切关系。
进一步研究发现,病毒稳定控制猴的组织潜伏库具有更少产生活病毒的能力,并且3组治疗猴的病毒特异CD8+T细胞应答存在差异,停药后病毒稳定控制猴的病毒特异性CD8+T反应更强、多功能CD8+T应答增加。
为进一步探明停药后实现病毒控制或部分控制的机制,他们将呈“停药后稳定的病毒控制”状态和“停药后病毒不稳定反弹”状态猴体内的CD8+T细胞敲除后,发现病毒载量迅速反弹。“这意味着CD8+T细胞对停药后病毒控制结局起到了关键作用,为后续功能性治愈药物研发的靶标选择和评价带来了新的思路与方法。”薛婧表示。
暴露前的预防
LP-98能用于艾滋病的预防保护吗?研究人员对LP-98进行了暴露前预防实验,发现LP-98暴露前预防用药的有效保护期为1周,能有效阻断SHIV和猴免疫缺陷病毒经过直肠、阴道或静脉途径的感染,因此可以作为艾滋病暴露前预防的新策略。
实际上,何玉先团队对艾滋病药物的研究已经持续开展了10多年,对GP41结构与功能进行了深入系统的研究,发现和定义了多个蛋白结构特征。经过反复筛选设计和无数次的失败后,研究人员最终使LP-98的抗病毒活性提高到目前的皮摩尔水平,而此前还历经了LP-11、LP-19、LP-40、LP-46、LP-52、LP-80、LP-83等渐进性优化提高阶段。
值得高兴的是,他们研制的靶向病毒膜融合的艾滋病新药“利普韦肽”作为国家1类新药,目前已进入临床试验并取得重要进展。
要想研究HIV的潜伏机制,必须构建相应的动物模型,这也是该研究的一大难点。在薛婧看来,适用于潜伏机制研究的动物模型需要精确模拟艾滋病感染、发病、药物治疗、病毒潜伏、停药后复发等各阶段。
为此,研究人员同步推进了药物的改良和动物模型的优化研究。动物模型从最初的急性感染模型起步,不断增加了慢性感染、治疗药物评价、长效药物控制、停药后反弹等阶段性特征,从而证明了LP-98是有效的HIV长效控制药物,而且能部分实现稳定病毒控制,也初步阐明了与停药后控制相关的病毒潜伏库特征及免疫机制。
何玉先表示,接下来,团队将致力于推动LP-98的临床试验,验证其临床预防和治疗效果,同时还将深入研究病毒潜伏与停药控制的机制,为治疗药物提供新的靶点选择。